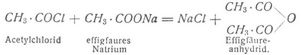- Anhydride
Anhydride. Unter Anhydridbildung versteht man in der organischen Chemie eine Reaktion, nach der ein direkter Wasseraustritt zwischen zwei Hydroxylgruppen entweder eines und desselben oder zweier verschiedener Moleküle stattfindet. Im allgemeinen kann man daher alle Substanzen als Anhydride bezeichnen, die durch einen derartigen Vorgang entstanden gedacht werden.
So sind die Aether die Anhydride der Alkohole, da sie aus zwei Molekülen derselben durch Wasserabspaltung abgeleitet werden können:
Im besonderen aber sind unter Anhydriden die Säureanhydride zu verstehen. Unter diesen unterscheidet man drei Arten: die Anhydride der einbasischen, die Anhydride der zweibasischen Säuren und die der Oxysäuren. Die ersteren entsprechen vollkommen den Aethern; wie diese aus zwei Molekülen der Alkohole, so entstehen sie aus zwei Molekülen einer einbasischen Säure, z.B.:
Wie in den Aethern zwei Alkoholradikale durch Sauerstoff verbunden sind – Oxyde der Alkoholradikale –, so vereinigt hier der Sauerstoff zwei Säureradikale – Oxyde der Säureradikale. Bei den zweibasischen Säuren findet die Wasserabspaltung zwischen den Hydroxylen der Karboxylgruppen eines und desselben Moleküls statt:
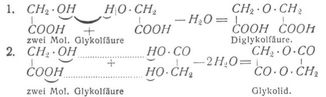
[199] Jedoch sind nicht alle Dikarbonsäuren zur Anhydridbildung befähigt. Bei den Oxysäuren kann die Anhydridbildung in dreierlei Weise erfolgen. Die wahren Säureanhydride, die durch Entnahme des Wassers aus den Karboxylgruppen entliehen, sind nicht bekannt. Vielmehr entflammt das Wasser entweder aus den beiden alkoholischen Hydroxylgruppen – Alkoholanhydride oder Anhydridsäuren – oder es wird der alkoholischen und der Hydroxylgruppe der Karboxylgruppe entzogen. – Esteranhydride. Auch bei dieser Art der Anhydridbildung treten zwei Moleküle der Säure in Reaktion, z.B.:
Während diese letztere Reaktion nur die α-Oxysäuren (s. Fettsäuren) zeigen, erfolgt die Wasserabspaltung bei den γ- und δ-Oxysäuren innerhalb desselben Moleküls; die entstehenden Anhydride heißen Laktone, z.B.:
Auch Anhydride der Thiosäuren sind bekannt. Eine allgemein gültige Eigenschaft aller Anhydride – mit Ausnahme natürlich der Anhydridsäuren, wie Diglykolsäure – ist ihre Neutralität; sie destillieren meist unzersetzt entweder unter gewöhnlichem Druck oder im Vakuum und sind entweder Flüssigkeiten oder kristallisierende Körper, unter welch letzteren das Phthalsäureanhydrid durch großes Kristallisationsvermögen ausgezeichnet ist. Mit Wasser bilden sie mehr oder weniger leicht die Ausgangssäure zurück; mit Alkoholen liefern sie Ester der Säuren.
Viele Anhydride entstehen durch bloßes Erhitzen der Säuren, so besonders die der zweibasischen Säuren, oder durch Einwirkung von Phosphorpentachlorid oder Acetylchlorid auf letztere; die der Fettsäuren gewinnt man durch Einwirkung der Säurechloride auf die wasserfreien Alkalisalze der Säuren:
Die Anhydride finden in der organischen Chemie allgemeinste Anwendung bei den mannigfachsten Reaktionen; so ist. das Essigsäureanhydrid besonders wichtig. Das Phthalsäureanhydrid ist die Muttersubstanz der für die Farbentechnik wichtigen Phthaleine u.s.w. Auch die anorganische Chemie kennt Anhydride sowohl von Säuren, wie z.B. Schwefelsäureanhydrid, als auch solche Anhydride, die aus den Hydraten der Basen durch Wasserentziehung entstehen und gleich den Oxyden der Elemente sind. So ist Calciumoxyd CaO das Anhydrid des Calciumhydrats Ca(OH)2. Die Anhydride der fetten Säuren wurden 1852 von Gerhardt entdeckt.
Literatur: Fittig, Annalen der Chemie, Bd. 208, S. 111; Bd. 216, S. 27; Bd. 226, 322 u. f.; Schmidt, Lehrbuch der pharm. Chemie, Braunschweig 1901.
Bujard.
http://www.zeno.org/Lueger-1904.