- Kryohydrate
Kryohydrate. Kühlt man eine gesättigte wässerige Lösung eines Salzes ab, so erreicht man ihren Gefrierpunkt, in welchem sich bei weiterer Wärmeentziehung Eis und Salz gleichzeitig abscheiden, so daß die Lösung gewissermaßen[726] als Ganzes gefriert. Das Mengenverhältnis von ausfrierendem Eis und Salz ist konstant, weil wegen der Sättigung der Lösung sich mit jedem Teilchen als Eis ausfrierenden Wassers die auf dieses Teilchen entfallende, vorher darin gelöst gewesene Menge Salz abscheiden muß [2].
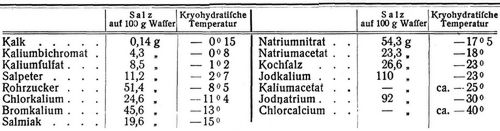
Da das Verhältnis von Eis und Salz häufig sich ganzzahligen molekularen Mengen nähert, so herrschte früher die irrtümliche Ansicht, es handle sich um wirkliche Hydrate wie die kristallwasserhaltigen Salze (s. Kristallwasser), daher der Name. Solche Kryohydrate entstehen stets, wenn man aus einer Lösung beliebiger Konzentration durch Ausfrieren von Eis (und dadurch bewirktes Anwachsen der Salzkonzentration in der Lösung) so viel Lösungsmittel entzieht, bis der flüssige Rest an Salz gesättigt ist, in welchem Moment die Salzausscheidung beginnt. Es ist ersichtlich, daß entsprechend der Konzentrationszunahme der Flüssigkeit der Gefrierpunkt (s.d.) immer tiefer geht, um bei Erreichung des »kryohydratischen Punktes« seine tiefste Lage zu erreichen, auf der auch das ganze System bis zum Festwerden der letzten Flüssigkeit bleiben muß, da deren Konzentration (als gesättigt) sich nicht mehr ändern kann. Dieser kryohydratische Punkt ist also auch die tiefste mit einem Gemisch von Salz und Eis erreichbare Temperatur, worin gleichzeitig die Theorie der Kältemischungen (s.d.) enthalten ist: bei der Berührung von festem Salz und schmelzendem Eis (von 0°) bildet ersteres zunächst eine gesättigte Lösung mit dem Schmelzwasser; durch fortgesetztes Schmelzen des Eises wird dieser gesättigten Lösung (die durch weiteres Sichlösen von Salz stets gesättigt bleibt) immer mehr Wärme entzogen, wodurch offenbar die Temperatur schließlich auf den Gefrierpunkt der gesättigten Salzlösung, also die kryohydratische Temperatur linken muß. Zur Erreichung dieser tiefsten Temperatur ist es wichtig, das Salz in feinpulveriger Form anzuwenden, damit es schnell in Lösung geht, während durch das Schmelzwasser des Eises die Lösung verdünnt wird. Auch durch ständiges Rühren ist dafür zu sorgen, daß das Salz verteilt wird und alle Teile der Lösung gesättigt erhält. Die folgende Tabelle enthält einige der von dem empirischen Entdecker der Kryohydrate, Guthrie, bestimmte bezw. von dem theoretischen Entdecker Guldberg berechnete Zahlen [3]:
Die kryohydratische Temperatur und die Zusammensetzung des Kryohydrates ist bei sehr großen Druckänderungen etwas veränderlich, was auch gegen ihre Auffassung als Verbindung spricht [1].
Literatur: [1] Ostwald, Lehrbuch der allgemeinen Chemie, 2. Aufl., Leipzig 1891, Bd. 1, S. 777. – [2] Nernst, Theoretische Chemie, Stuttgart 1893. – [3] Winkelmann, Handbuch der Physik, Breslau 1896, Bd. 2, 2, S. 628.
Abegg.
http://www.zeno.org/Lueger-1904.