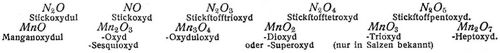- Oxydation, Oxyde
Oxydation, Oxyde. Unter Oxydation versteht man Prozesse, durch die einerseits Elementen oder chemischen Verbindungen Sauerstoff zugeführt, anderseits wasserstoffhaltigen Verbindungen Wasserstoff durch Zuführung von Sauerstoff entzogen wird, der den Wasserstoff zu Wasser verbrennt.
Einfache Beispiele der Oxydation durch Sauerstoffzufuhr sind die Verbrennung der Kohle C zu Kohlendioxyd CO2, des Schwefels S zu Schwefeldioxyd SO2, des Phosphors P zu Phosphorpentoxyd P2O5. Oxydation durch Entziehung von Wasserstoff findet statt z.B. bei der Oxydation des Chlorwasserstoffs zu Chlor: 2HCl + O = H2O + Cl2 oder bei der Oxydation des Schwefelwasserstoffs zu Schwefel: H2S + O = H2O + S. Die Oxydation wird bewirkt durch direkte Einwirkung von Sauerstoff oder Luft, entweder bei gewöhnlicher oder bei höherer Temperatur. Die Oxydation bei hoher Temperatur unter Feuererscheinung wird als Verbrennung bezeichnet. Natrium Na oxydiert sich an trockener Luft zu Natriumoxyd Na2O, Stickoxyd zu Salpetrigsäureanhydrid nach 4NO + O2 = 2N2O3. Beispiele für die Verbrennung sind oben angeführt worden. Man führt die Oxydation auch aus mit Hilfe von Oxydationsmitteln; das sind Sauerstoffverbindungen, die ihren Sauerstoff entweder teilweise oder vollständig abzugeben vermögen und je nach der Leichtigkeit, mit der dies geschieht, mehr oder minder energisch wirken. Oxydationsmittel sind Salpetersäure, Chlorsäure, unterchlorige Säure, Chlorkalk, Kaliumpermanganat, Chromsäure, Silberoxyd, Superoxyde, wie Natrium-, Mangan- und Bleisuperoxyd, ferner Chlor, das sich bei Gegenwart von Wasser in Salzsäure und wirksamen Sauerstoff umsetzt nach Cl2 + H2O = 2HCl + O. Sie wirken bei gewöhnlicher oder erhöhter Temperatur, einige wie Salpeter erst beim Schmelzen ein. – Oxyde sind die Sauerstoffverbindungen der Elemente. Bildet ein Element mehrere Oxyde, so unterscheidet man diese je nach dem Gehalt an Sauerstoff als Suboxyd, Oxydul, Oxyd, Sesquioxyd, Superoxyd (Peroxyd, Hyperoxyd), Hydroxyde; oder man bezeichnet das Oxyd nach der Anzahl der vorhandenen Sauerstoffatome als Tri-, Tetra-, Pentoxyd. Als Beispiele seien angeführt:
Die Oxyde der Metalloide (s.d.) und die höheren Oxyde gewisser Metalle (s.d.) verbinden sich mit Wasser zu Säuren:
Die in Wasser löslichen Oxyde der Metalle bilden mit dem Wasser Hydroxyde oder Basen:
Die den in Wasser nichtlöslichen Oxyden entsprechenden Hydroxyde erhält man durch Fällung der betreffenden Metallsalze mit Basen:
FeCl2 + 2KOH = 2KCl + Fe(OH)2 Eisenhydroxydul,
FeCl3 + 3 KOH = 3KCl + Fe(OH)3 Eisenhydroxyd.
Neben säurebildenden und basenbildenden Oxyden hat man noch indifferente Oxyde, die mit Wasser weder Säuren noch Basen geben, wie
[787] Durch Wechselwirkung der Säuren und Basen oder basenbildenden Oxyde entstehen die Salze, die als Oxydul- oder Oxydsalze bezeichnet werden, je nach der Oxydationsstufe der in Reaktion getretenen Base oder des entsprechenden Oxyds.
Hg2O + 2HNO3 = H2O + Hg2(NO3)2 Quecksilberoxydulnitrat,
HgO + 2HNO3 = H2O + Hg(NO3)2 Quecksilberoxydnitrat.
Der Oxydation entgegengesetzt ist der Prozeß der Reduktion, der Anlagerung von Wasserstoff oder der Entziehung von Sauerstoff (s. Reduktion).
(Kerp) Bujard.
http://www.zeno.org/Lueger-1904.