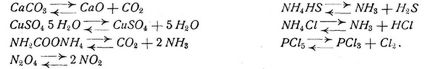- Dissoziation
Dissoziation nennt man ganz allgemein den Zerfall einer Molekel in mehrere kleinere Teilmolekeln, jedoch mit der Einschränkung, daß dieser Zerfall[780] nicht vollständig ist und gewissen physikalischen Einflüssen unterliegt, durch die er zurückgedrängt oder vergrößert wird (s. Dissoziationsisotherme). Allgemein kennzeichnet sich der Zustand der Dissoziation als der Gleichgewichtszustand einer umkehrbaren Reaktion zwischen den undissoziierten Molekeln und ihren Dissoziationsprodukten.
Je nach der Natur der sich dissoziierenden Körper oder ihrer Dissoziationsprodukte unterscheidet man verschiedene Arten, z.B. diejenige fester Körper, kristallwasserhaltiger Salze, von Gasen, die elektrolytische. Beispiele solcher in Form einer umkehrbaren Reaktionsgleichung gekleideten Dissoziationen sind:
Eine Dissoziation besonderer Art ist diejenige elektrolytisch leitender Stoffe in elektrisch geladene Teilmolekeln, die sogenannten »Ionen«, wonach sie als elektrolytische Dissoziation oder auch als Ionisation bezeichnet wird. Dies ist die häufigste aller Dissoziationserscheinungen und, obwohl sie erst 1887 durch Arrhenius entdeckt ist, auch am vielseitigsten erforscht.
Wenn man die Ionen entsprechend ihrer elektrischen Ladung mit + bezw. – überzeichnet, so lassen sich derartige Dissoziationen folgendermaßen schreiben:
Unter »stufenweiser Dissoziation« versteht man die Möglichkeit, daß Teilmolekeln, also die Dissoziationsprodukte der ursprünglichen Molekeln, ihrerseits noch einer weiteren Dissoziation unterliegen, die sich der ersten superponiert; Beispiele sind:
Der als hydrolytische Dissoziation bezeichnete Zerfall von Salzen schwacher Säuren und Basen in wässeriger Lösung in Basis und Säure ist, streng genommen, keine Dissoziation, da das Wasser hier an der Reaktion teilnimmt, so daß auf keiner Seite der Reaktionsgleichung nur ein Stoff steht:
Literatur: Nernst, Theoret. Chemie, betr. elektrolyt. Dissoziation; insbesondere Abegg, Theorie d. elektr. Dissoziation, Stuttgart; Ahrens' Sammlung ehem. Vorträge, 1903.
Abegg.
http://www.zeno.org/Lueger-1904.