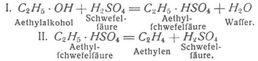- Aethylen
Aethylen (Elayl, ölbildendes Gas, schweres Kohlenwasserstoffgas), C2H4 oder CH2 = CH2 Molekulargewicht 28.
Es entsteht bei der trockenen Destillation fettsaurer Salze, der Fette, Harze, des Holzes und der Steinkohlen und ist deshalb ein wichtiger Bestandteil der aus diesen Körpern gewonnenen Gase, also auch des Leuchtgases. Das Aethylen bildet sich beim Erhitzen von Methylenjodid (CH2J2) mit Kupfer auf 100° C., ferner durch Einwirkung von Natrium auf Aethylenchlorid (
), durch Reduktion von Acetylenkupfer mit Zinkstaub und Ammoniak u.s.w.
Die Darstellung erfolgt nach Erlenmeyer und Bunte: Man stellt einen mit Tropftrichter und Gasableitungsrohr versehenen Kochkolben von 2–3 l Inhalt auf ein Sandbad, verbindet das Gasableitungsrohr am zweckmäßigsten mit vier Woulffschen Flaschen und die[97] letzte Flasche mit einem Gasometer. In den Kolben bringt man eine Mischung von 25 g Aethylalkohol und konzentrierter Schwefelsäure, erhitzt dieses und läßt aus dem Tropftrichter ein erkaltetes Gemisch gleicher Teile Aethylalkohol und konzentrierter Schwefelsäure so nachtropfen, daß die Gasentwicklung ununterbrochen weitergeht. Die erste Woulffsche Flasche ist leer, die zweite ist halb mit konzentrierter Schwefelsäure angefüllt. In diesen werden die mit überdestillierenden Alkohol- und Aetherdämpfe zurückgehalten, in der dritten und vierten Woulffschen Flasche wird die mit dem Aethylen entstehende Kohlensäure und das schwefligsaure Anhydrid zurückgehalten, zu welchem Zweck diese beiden Vorlagen zu 2/3 mit Natronlauge angefüllt sind. Von den vier Flaschen aus wird dann das Aethylen Feinem Bestimmungsort zugeleitet, also entweder in einen Gasbehälter oder zur sofortigen weiteren Verwendung.
Zunächst entsteht Aethylschwefelsäure, die jedoch bei stärkerem Erhitzen in Aethylen und Schwefelsäure zerfällt.
Das Aethylen ist ein schwach ätherisch riechendes, farbloses Gas, das an der Luft mit leuchtender Flamme brennt, 1 Volum Aethylen und 3 Volum Sauerstoff gemischt und entzündet, explodiert. Dasselbe ist der Fall, wenn man Aethylen mit stark ozonisiertem Sauerstoff zusammenbringt. Das spez. Gew. (Luft = 1) beträgt 0,9784. Das Aethylen wird bei 0° und einem Druck von 42,5 Atm. flüssig (farblos, leicht beweglich). Diese Flüssigkeit siedet bei –102 bis –103°C. und erzeugt beim Verdunsten im Vakuum eine Kälte von –136°C. Bei –181,4°C. wird es fest und bildet eine kristallinische Masse. In Wasser ist das Aethylen wenig löslich, dagegen lösen Aether und Alkohol etwa 2 Volumina. Das Aethylen ist ein Olefin oder Alkylen, es ist das niedrigste Glied in der Reihe der ungesättigten Kohlenwasserstoffe von der allgemeinen Formel CnH2n, die man als Olefine oder Alkylene bezeichnet. Wie alle Olefine ist das Aethylen befähigt, zwei einwertige Atome zu addieren; so verbindet es sich leicht mit Chlor, Brom, Jod; mit Jodwasserstoffsäure bildet es Jodäthyl, mit Wasserstoffgas über Platinschwamm geleitet, vereinigt es sich zu Aethan. Das Aethylenchlorid verdient als »Oel der holländischen Chemiker« (vgl. oben) einiges Interesse, weil es früher als Anästhetikum viel benutzt wurde. Bei der Ausbildung der Radikaltheorie (s.d.) spielte das Aethylen in der sogenannten Dumasschen Aetherintheorie (um 1839) eine Rolle, indem in allen sich von Alkohol ableitenden Verbindungen die Gruppe C2H4 als präexistierend angenommen wurde.
Aethylen dient zur Erzeugung niedriger Temperaturen.
Literatur: Beilstein, Handbuch der organ. Chemie; Erlenmeyer-Bunte, Annalen der Chemie, 168, 64; 192, 244. – Kekulé, Lehrbuch der org. Chemie, Erlangen 1861. – Schmidt, Lehrbuch der Pharm. Chemie, org. Teil, 1902.
Bujard.
http://www.zeno.org/Lueger-1904.