- Baryum
Baryum Ba, Atomgewicht 137, spez. Gew. 3,75; Metall, weich wie Blei und silberweiß.
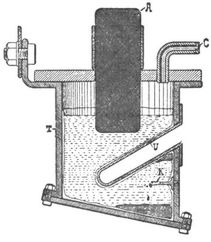
An der Luft oxydiert es leicht und zersetzt Wasser energisch schon bei gewöhnlicher Temperatur. Mit Wismut und Zinn sowie mit Aluminium lassen sich Baryumlegierungen herstellen, die zum Teil das Wasser wie das Baryum selbst zersetzen. Die Darstellung des Metalles bietet Schwierigkeiten. Sie geschieht auf elektrotechnischem Wege mittels geschmolzener Haloidsalze. Für dieses Verfahren gelten noch die Bedingungen, die Bunsen und Matthiessen schon anfangs der fünfziger Jahre ermittelt hatten [2], [3]. Der damals vorgeschlagene Apparat gestattete aber nur die Darstellung sehr geringer Mengen des Metalles. Die Schwierigkeiten der Ausführung dieses Verfahrens, die eingehend in [4] und [5] geschildert sind, liegen hauptsächlich in der Erfüllung zweier sich entgegenstehender Anforderungen. Die Rücksicht auf die Haltbarkeit der Schmelzgefäße verlangt eine niedrige Temperatur, also leicht schmelzbare[551] Elektrolyte, der hohe Schmelzpunkt des Metalles dagegen hohe Temperatur, wenigstens am Orte der Abscheidung. Diesem Umstande kommt allerdings die Notwendigkeit einer sehr hohen Stromdichte an der Kathode zu Hilfe. Nach vielen vergeblichen Versuchen hat sich schließlich folgender in [5] veröffentlichter Apparat von Borchers bewährt, um einigermaßen greifbare Mengen Metall zu erhalten: Als Zersetzungsgefäß dient ein schmiedeeiserner Tiegel T (vgl. die Figur), in den ein Einschnitt gemacht ist. Dieser Einschnitt wird durch ein gut passendes U-förmig gebogenes Eisenblech U ausgefüllt. Unterhalb desselben sind in die Tiegelwandung Stifte K eingeschraubt, die als Kathoden dienen sollen. Die Größe derselben ist so gewählt, daß auf jeden Quadratmillimeter während der Elektrolyse freibleibender Oberfläche etwa 1 Ampere Strom trifft. Als Anode dient ein kräftiger Kohlestab A oder ein Bündel von dünnen Kohlestäben oder Kohleplatten. Zur Ableitung des Halogens ist ein Rohr C vorgesehen. Die Arbeitsweise ist folgende: Der Elektrolyt, geschmolzene Haloidsalze des Baryums, wird in den kalten Tiegel eingegossen. Gleich darauf taucht man oben in die Schmelze den erhitzten Kohlestab ein und stellt Verbindung mit der Stromquelle her. Die Wandungen des Behälters werden sich mit einer Kruste erstarrter Schmelze bedecken. Man erhält diese Kruste an den Wandungen dadurch, daß man dem Gefäße von außen dauernd oder von Zeit zu Zeit irgend ein Kühlmittel, kaltes Wasser oder kalte Luft, zuführt. Die Kruste isoliert die Tiegelwandungen vollständig. Nur von den tiefer in die Schmelze hineinragenden Stiften K wird dieselbe schnell wieder abgeschmolzen sein. Dann beginnt sofort die Stromarbeit Den Widerstand der Schmelze wählt man so groß, daß der elektrische Strom eine hinreichend starke Erwärmung veranlaßt, um den Elektrolyten flüssig zu erhalten. Infolge der großen Stromdichte an der Kathode wird diese außerdem weit über die Temperatur der Umgebung erhitzt. Das sich hier abscheidende Metall kann sich daher an dieser Stelle zu geschmolzenen Massen vereinigen, die abfallen oder in die Höhe steigen, um am Boden des Tiegels oder unter dem schräg eingefügten Einsatze U zu erstarren. Man kann nämlich bei den Erdalkalimetallen beobachten, daß das Verhältnis der spezifischen Gewichte von Metall und Schmelze mit Temperaturschwankungen ganz wesentlichen Aenderungen unterworfen ist. Das Metall wird also, diesen Temperaturschwankungen entsprechend, zum Teil zu Boden sinken, zum Teil nach oben steigen. Durch eine Einrichtung, wie sie der Apparat zeigt, sind jedoch viele Metallverluste vermieden. Alle Metallverluste sind nicht zu umgehen. Die große Stromdichte verursacht in der Schmelze starke Strömungen, so daß viel Metall in den Anodenraum hineingeschwemmt wird, wo es natürlich verbrennt. Ein Teil des Metalles wird auch nach dem Abtropfen von der Kathode von den Haloidsalzen unter Bildung von Oxydulsalzen gelöst. Borchers hat trotz dieses Apparates nur Ausbeuten von höchstens 20% der theoretischen erreicht. Es ist dies aber immerhin ein ganz wesentlicher Fortschritt, wenn man bei Benutzung der bisher bekannten Vorrichtungen mit einer Ausbeute von höchstens 5% der theoretischen zufrieden sein mußte. – Anwendung fand das Metall in der Technik seines hohen Preises (10–30 ℳ. per Gramm) wegen bisher gar nicht. – Wenn es auch schon anfangs dieses Jahrhunderts von Davy [1] entdeckt wurde, so ist es doch unwahrscheinlich, daß er reines Metall bei seinen Versuchen erhalten hatte. Das erste reine Metall wurde in den fünfziger Jahren von Bunsen und Matthiessen dargestellt.
Literatur: [1] Davy, Philos. Transact., 1808. – [2] Bunsen, Pogg. Ann., Bd. 91, S. 619. – [3] Bunsen und Matthiessen, Liebigs Ann., Bd. 93, S. 277. – [4] Borchers, Elektrometallurgie, Braunschweig 1891. – [5] Ders., Zeitschr. f. angew. Chemie, 1893, S. 486; Muspratts Handbuch der techn. Chemie, Bd. 1, Braunschweig 1888.
Bujard.
http://www.zeno.org/Lueger-1904.