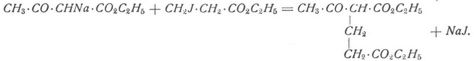- Acetessigester
Acetessigester, Acetessigsäureäthylester (Acetylessigäther) C6H10O3.
Darstellung: Man bringt 100 g in kleine Würfel geschnittenes metallisches Natrium in einen Kolben mit Rückflußkühler, in dem sich 100 Teile vollkommen reinen Essigäthers befinden. Nach kurzer Zeit gerät dieser ins Sieden; wenn das Sieden nachläßt, bezw. wenn die Reaktion nicht von selbst eintritt, wird so lange auf dem Wasserbad erwärmt, bis alles Natrium in Lösung gegangen ist, dann destilliert man den überschüssigen Essigäther ab. Die noch warme flüssige Masse versetzt man mit 550 g 50 prozentiger Essigsäure und nach dem Erkalten mit 550 g Wasser, hebt den ausgeschiedenen Aether ab, entwässert mit Chlorcalcium und rektifiziert ihn. Der zwischen 170 und 180° überdestillierende Anteil ist saß reiner Acetessigester.
Vorgang:
1. 2CH2∙CO2C2H5+ Na2 = CH3∙CO∙CHNa∙ CO2C2H5 + C2H5∙ONa + H2.
2. CH3∙CO∙CHNa∙CO2C2H5 + CH3∙COOH = CH3∙CO∙CH2∙CO2C2H5 + CH3∙COONa.
Mit dem Verlauf der durch die erste Gleichung ausgedrückten Reaktion haben sich namentlich A. v. Baeyer [2] und Claisen [3] beschäftigt.
Eigenschaften: Der Acetessigester bildet eine farblose, angenehm obstartig riechende Flüssigkeit, die bei 181°C. siedet und bei 20°C. ein spezifisches Gewicht von 1,0256 besitzt. Mit Wasserdämpfen ist er leicht flüchtig, in Wasser wenig löslich. Die wässrige Lösung wird durch Eisenchlorid violett gefärbt. Bei mehrstündigem Erhitzen auf 230–250° C. zerfällt er in Essigsäureäthyläther und in die bei 108°C. schmelzende und bei 209°C. siedende Dehydracetsäure C8H8O4. Analog der Bildung des Aethylesters aus dem Essigsäureäthylester entstehen die homologen Acetessigsäureester aus den entsprechenden Eltern der Essigsäure. Die dem Acetessigester zugrunde liegende Acetessigsäure
gehört zu den β–Ketonsäuren, d.h. den Säuren, welche die für die Ketone charakteristische Karbonylgruppe CO in β-Stellung zur Karboxylgruppe COOH enthalten. Die β-Ketonsäuren sind sehr unbeständig; dementsprechend zerfällt die Acetessigsäure ungemein leicht in Aceton und Kohlensäure:
Der Acetessigester selbst ist beständiger, aber eine durch außerordentliche Reaktionsfähigkeit ausgezeichnete Verbindung. So zeigt er alle für die Ketone charakteristischen Reaktionen: er verbindet sich mit Blausäure, Hydroxylamin, Phenylhydrazin, Ammoniak, Anilin u.s.f. (s. Acetessigestersynthesen). Mit Alkalien erleidet der Acetessigester eine doppelte Spaltung, indem entweder zwei Moleküle Essigsäure neben Alkohol oder Kohlensäure, Aceton und Alkohol entstehen. Die erstere wird als Säure-, die zweite als Ketonspaltung bezeichnet. Durch Reduktion entsteht aus dem Acetessigester neben Alkohol die β-Oxybuttersäure. Die beiden Wasserstoffatome der Methylengruppe CH2 des Acetessigesters sind durch Metalle vertretbar. So entsteht durch Einwirkung von Natriumäthylat der Natracetessigester CH2·CO·CHNa·CO2C2H5, der auch bei der Darstellung des Acetessigesters erhalten wird. Das Kupfersalz hat die Zusammensetzung (C6H9O3)2Cu [4]. – Durch Umsetzung der Natriumverbindung mit Halogenalkylen oder überhaupt solchen organischen Verbindungen, die ein leicht austauschbares Halogen im Molekül enthalten, entstehen substituierte Acetessigester [5]. So entsteht aus der Natriumverbindung mit Jodmethyl der Methylacetessigester nach der Gleichung:
Durch Einwirkung von β-Jodpropionsäureester z.B. wird der a-Acetylglutarsäureester gebildet:
Anwendung: Wie aus obigem schon hervorgeht, bildet der Acetessigester ein ungemein ergiebiges Ausgangsmaterial zur Darstellung einer großen Reihe wichtiger Verbindungen (s. Acetessigestersynthesen): Er dient zur Synthese von Ketonen, ein- und mehrbasischen Säuren, Oxysäuren, u.a. auch zur Darstellung des Antipyrins.
Literatur: [1] Wislicenus und Conrad, Annalen d. Chemie, 186, 210. – [2] A. v. Baeyer, Berichte d. deutschen ehem. Gesellsch., 18, 3456 und 3460. – [3] Claisen, Berichte d. deutschen ehem. Gesellsch., 20, 651. – [4] M. Conrad und M. Guthzeit, Berichte d. deutschen ehem. Gesellsch., 19, 21. – [5] Vgl. z.B. Conrad und Limpach, Annalen d. Chemie, 192, 153; Conrad und Brückner, Zeitschr. f. physikal. Chemie, 7, 283.
Bujard.
http://www.zeno.org/Lueger-1904.