- Stickstoffindustrie
Stickstoffindustrie in engerem Sinne befaßt sich mit der technischen Ueberführung atmosphärischen Stickstoffs in gebundene Form; in weiterem Sinne rechnet man zur Stickstoffindustrie auch die Gewinnung des Chilesalpeters und des Ammoniaks bei der Vergasung und Entgasung der Kohle. Obwohl die Synthese von Stickstoffverbindungen aus Luftstickstoff und Sauerstoff resp. Wasserstoff längst bekannt war – 1786 hat Cavendish durch Einwirkung des elektrischen Funkens Stickoxyde dargestellt, 1846 Régnault auf gleichem Wege Ammoniak –, ist eine technische Auswertung der Stickstoffbindung erst im Beginn des gegenwärtigen Jahrhunderts erfolgt, nachdem die notwendigen elektrotechnischen und physikochemischen Unterlagen einer solchen Fabrikation vorhanden waren, als sich zunehmender Bedarf an Stickstoffverbindungen für landwirtschaftliche Zwecke geltend machte und die Erschöpfung der chilenischen Salpeterlager in nahe Zeit gerückt schien; von besonders förderlichem Einfluß auf das Anwachsen der Stickstoffindustrie ist dann weiter der Weltkrieg gewesen, indem durch das Aufhören der Salpetereinfuhr die Mittelmächte zur Ausnutzung anderer Quellen gebundenen Stickstoffs in allergrößtem Maßstabe genötigt wurden. Von technisch ausgeführten Verfahren zur Ueberführung des Stickstoffs in gebundene Form sind hauptsächlich zu nennen: 1. Oxydation des Stickstoffs zu Stickoxyden (Verfahren von Birkeland-Eyde, Schönherr, Pauling und Häußer); 2. Bindung des Luftstickstoffs durch Karbide (Verfahren von Frank-Caro und Serpek); 3. direkte Vereinigung von Stickstoff und Wasserstoff (Haber-Prozeß); hierzu 4. als Bindeglied zwischen den genannten Prozessen die Oxydation von Ammoniak zu Stickoxyden nach Ostwald, Frank-Caro und anderen.
1. Oxydation des Stickstoffs zu Stickoxyd. – Die Bildung von Stickoxyd aus Stickstoff und Sauerstoff ist ein umkehrbarer und endothermer Vorgang, der sich nach folgender Gleichung vollzieht: N2 + O2 = 2NO ± 43,2 Kalorien. Hohe Temperatur, wie sie im elektrischen Lichtbogen vorliegt, ist also der Stickoxydbildung günstig, indes bei geringerer Temperatur wieder Zerfall in die Elemente eintritt. Eine Temperatur von weniger als 1000° verschiebt zwar das Gleichgewicht noch mehr zuungunsten des Stickoxyds, doch geht dann andererseits der Zerfall so langsam vonstatten, daß er praktisch nicht mehr in Erscheinung tritt. Das Prinzip der technischen Stickoxyddarstellung geht also darauf hinaus, zunächst die Luft möglichst hoch im Lichtbogen zu erhitzen und dann so rasch unter 1000° abzukühlen, daß der Wiederzerfall möglichst hintangehalten wird. Die näheren Bedingungen des Prozesses sind von Nernst sowie von Haber und ihren Schülern untersucht worden; letzterer hat dabei festgestellt, daß bei der Stickstoffoxydation im elektrischen Lichtbogen nicht nur thermische Einflüsse geltend sind, sondern auch eine elektrische Aktivierung vor sich geht, wenn auch unter den Bedingungen des technischen Prozesses schließlich nur das thermische Gleichgewicht erkennbar ist. Nernst hat folgende Mengen Stickoxyd im Gleichgewicht bei verschiedenen Temperaturen festgestellt:
Vol.-Proz. T NO abs. 1 2202 2 2571 4 3103 6 3541 [602] Die im praktischen Betrieb erzielten Ausbeuten übersteigen kaum einen Gehalt von 2 bis 2,5% NO. Zur Ueberführung der Luft in Stickoxyd ist ein verdünnter Hochspannungswechselstrom-Lichtbogen erforderlich. Das Auseinanderziehen des gewöhnlichen Lichtbogens zu großer Fläche oder auf große Länge kann auf verschiedene Arten geschehen. Das älteste Verfahren (Versuche zur Stickoxydherstellung in industriellem Maßstabe waren schon früher von Bradley und Lovejoy am Niagarafall angestellt worden; wegen der ungeeigneten Apparatur ist das Verfahren aber 1904 wieder eingestellt worden), das der Norweger Birkeland und Eyde (seit 1903 im Versuchsbetrieb), erzielt dies dadurch, daß senkrecht zu den Elektroden die beiden Pole eines starken Elektromagneten angebracht sind, wodurch der Lichtbogen zu einer flachen Scheibe von mehreren Metern Durchmesser ausgedehnt wird.
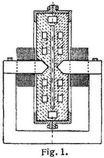
Fig. 1 zeigt einen schematischen Schnitt durch den aus Schamotte bestehenden Ofen. Rechts und links befinden sich die beiden Pole des Elektromagneten. Senkrecht dazu, auf dem Bilde nicht sichtbar, stehen die beiden wassergekühlten Kupferelektroden, zwischen denen der Wechselstromlichtbogen von 5000 Volt übergeht. Der zur Scheibe ausgedehnte Lichtbogen breitet sich in dem mittleren Räume aus; die Luft zirkuliert zum Zwecke der Vorwärmung in den seitlichen Kanälen, tritt dann durch die Flammenscheibe hindurch und verläßt den Ofen wieder mit einem Gehalt von etwa 2% NO.
Die Badische Anilin- und Sodafabrik hat ein besonderes, von Schönherr flammendes Verfahren in die Praxis eingeführt. Der zur Stickstoffoxydation dienende Apparat (Fig. 2) besteht im wesentlichen aus einem langen Eisenrohr, das unten eine wassergekühlte Kupferelektrode E enthält, durch die ein verschiebbarer Eisenstab hindurchgeführt ist. Mit Hilfe des Zündstabes z wird ein Lichtbogen erzeugt. Die in Richtung der Pfeile einströmende Luft wird zunächst vorgewärmt und tritt dann tangential in das innere Rohr ein, wobei sie unter Wirbelbildung den Lichtbogen zu einer langen Flamme mit emporreißt; das als Gegenpol dienende eiserne Gehäuse ist geerdet. Der Prozeß kann durch die Schaulöcher g beobachtet werden. Im oberen Teile wird die Luft durch Wasserkühlung abgeschreckt und verläßt dann den Apparat mit einem Gehalt von etwa 2,5% NO. Eine Kilowattstunde liefert etwa 75 g HNO3 gegen 70 g beim Verfahren von Birkeland-Eyde. Die weitere Verarbeitung des Stickoxydes erfolgt bei beiden Verfahren so, daß man zunächst abkühlt und in Türmen spontane Oxydation zu NO2 eintreten läßt. Dann läßt man die Gase in mit Quarzbrocken gefüllten Granittürmen im Gegenstrom auf Wasser einwirken, wobei man schließlich eine verdünnte Salpetersäure von 35 bis 40% HNO3 erhält; stärkere Säure von 50 bis 60% kann durch Konzentrieren, fast wasserfreie durch Destillation mit konzentrierter Schwefelsäure gewonnen werden. Die Einwirkung von Stickdioxyd auf Wasser geht etwa nach folgender Gleichung vor sich: 3NO2 + N2O = 2HNO3 + NO. Die letzten Reite von Stickoxyden werden schließlich bis auf 3–4% in mit Kalkmilch berieselten Türmen zurückgehalten. Die verdünnte Salpetersäure wird meist in Granitwannen mit Kalkstein neutralisiert; durch Eindampfen der Lösung, wobei die Wärme der Ofengase ausgenutzt wird, erhält man schließlich den sogenannten Norgesalpeter, ein Calciumnitrat mit etwa 13% Stickstoff.
Läßt man die Oxydation der Ofengase nur bis zu einem stöchiometrischen Gemisch von NO und NO2 gehen, das sich bei 1200–1300° bildet, so kann daraus durch Einwirkung auf Sodalösung Natriumnitrit erhalten werden: Na2CO3 + NO + NO2 = 2NaNO2 + CO2.
Diese Reaktion hat zuerst das Interesse der deutschen Farbenfabriken, die Natriumnitrit in großen Mengen zum Diazotieren benötigen, auf die Stickstoffoxydation gelenkt; eine in Christianssand von der Badischen Anilin- und Sodafabrik errichtete Anlage hat hauptsächlich dieses Produkt hergestellt. Die nach dem Verfahren von Birkeland-Eyde in Notodden arbeitende norwegisch-französische Gesellschaft hat sich dann später mit dem deutschen Konzern geeinigt, und die gemeinschaftlich am Rjukanfall errichtete neue große Fabrik hat Anlagen nach beiden Verfahren in Betrieb gesetzt; die erste Anlage am Rjukanfall arbeitet mit 140000 PS., wozu ab 1916 noch eine zweite Anlage mit 160000 PS. hinzugetreten ist. Die deutschen Fabriken haben sich von dem Unternehmen vollständig zurückgezogen; der Grund war hauptsächlich der, daß sich die Badische Anilin- und Sodafabrik ganz dem weiteren Ausbau des Haber-Prozesses widmen wollte. Die Ausfuhr an Norgesalpeter betrug 1914 75176 t, der innernorwegische Verbrauch 6000 t. 1915 ging die Ausfuhr auf 38168 t zurück.
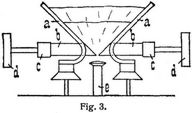
Ein drittes Verfahren zur Stickoxyddarstellung, von den Gebrüdern Pauling stammend, ist von der Salpetersäureindustrie-Gesellschaft (Gelsenkirchen) in Patsch bei Innsbruck in Betrieb gesetzt worden. Weitere Anlagen befinden sich in Frankreich und den Vereinigten Staaten von Nordamerika. Die für das Verfahren charakteristischen Elektroden a sind nach Art der Hörner-Blitzableiter gebogen (Fig. 3). Mit Hilfe von zwei schmalen kupfernen Zündschneiden b, die durch die wassergekühlten Eisenelektroden hindurchtreten, wird der Lichtbogen erzeugt, der durch die aus der Düse e austretende, zweckmäßig vorgewärmte Luft emporgetragen wird, oben bei jeder Halbperiode[603] des Wechselstroms abreißt, um sich unten wieder von neuem zu entzünden; es bildet sich so eine Flamme von etwa 1,5 m Höhe. Die Elektroden halten etwa 500 bis 600 Brennstunden aus, indes die Zündschneiden häufig zu erneuern sind. Die Luft verläßt die Ofen, in denen je zwei in Serie geschaltete Lichtbogen brennen, mit einem Stickoxydgehalt von 1,1 bis 1,2%. Die Ausbeute, auf HNO3 berechnet, beträgt etwa 60 g pro Kilowattstunde. Die weitere Verarbeitung des NO auf Salpetersäure und Natriumnitrit erfolgt nach den bereits oben geschilderten Prinzipien.
Ein Verfahren, das auf rein thermischem Wege Stickoxyd liefert, ist von Häußer ausgearbeitet worden. Bei diesem Prozeß wird Kokereigas in geschlossenen Gefäßen zur Explosion gebracht, wobei sich infolge der hohen Temperatur eine gewisse Menge Stickoxyd bildet, das durch rasches Abschrecken erhalten bleibt. Eine Versuchsanlage ist auf der Zeche de Wendel bei Hamm errichtet worden; ein weiterer Ausbau ist jedoch nicht erfolgt.
2. Stickstoffbindung durch Karbide (Kalkstickstoff und Aluminiumnitrid). – Frank und Caro hatten 1895 festgestellt, daß Erdalkalikarbide, besonders Baryumkarbid in erhitztem Zustand Luftstickstoff zu binden vermag. Durch Mitarbeit von Rothe u.a. gelang es, beim Calciumkarbid auftretende Schwierigkeiten zu überwinden und festzustellen, daß bei der Reaktion nicht Cyanide, sondern nach folgender Gleichung Cyanamid gebildet wird: CaC2 + N2 = CaCN2 + C. – Die Uebersetzung des Verfahrens in den Großbetrieb durch die daraufhin gegründete Cyanidgesellschaft machte zunächst wegen der hohen Temperatur von 1100°, die für die Reaktion notwendig ist, große apparative Schwierigkeiten, bis es gelang, diese durch Initialzündung, Erhitzung von einer Stelle aus, zu überwinden. Inzwischen hatte bereits 1905 die Aktiengesellschaft für Stickstoffdünger, Westeregeln, Kalkstickstoff als Düngemittel auf den Markt gebracht; die Gesellschaft arbeitete nach dem Verfahren von Polzenius, der durch Zumischung von Chlorcalcium die zur Stickstoffbindung notwendige Temperatur um 400 bis 500° herabdrückt. Beide Konzerne haben sich später geeinigt; neben acht ausländischen Gesellschaften arbeiteten vor dem Kriege in Deutschland drei Fabriken und zwar die Bayrischen Stickstoffwerke in Trostberg nach Frank-Caro unter Ausnutzung der Wasserkräfte der Alz, die Aktiengesellschaft für Stickstoffdünger in Knapsack bei Köln und die Mitteldeutschen Stickstoffwerke in Groß-Kayna bei Merseburg nach Polzenius; die beiden letzteren Fabriken werden mit Braunkohle betrieben.
Bei dem Verfahren von Frank-Caro wird das zweckmäßig unter Einleiten von Stickstoff feingemahlene Karbid in korbartige eiserne Behälter eingefüllt und mit diesen dann in mit feuerfesten Steinen ausgekleidete Zylinder eingesetzt; in die Mitte wird ein Kohlestab eingesenkt, der als Elektrode dient. Nach dem Verschließen der Zylinder wird Stickstoff eingepreßt, der in einer besonderen Anlage nach dem Lindeschen Verfahren gewonnen wird. Der Kohlestab wird durch elektrische Widerstandsheizung auf die notwendige Temperatur gebracht und bewirkt so das Einleiten der exothermen Reaktion, die dann selbständig durch die Masse fortschreitet. Das erhaltene Cyanamid wird schließlich sein gemahlen und durch Wasserstaub von den beigemengten Karbiden und Phosphiden befreit.
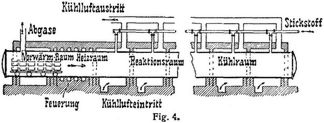
Bei dem Verfahren von Polzenius wird Karbid mit einem Gehalt von 10% Chlorcalcium in 30 cm hohe, zerlegbare Eisenkästen eingefüllt, die, etagenförmig auf eisernen Wagen aufgebaut, in den Kanalofen (Fig. 4) eingeschoben werden. Das Material wird zunächst vorgewärmt, dann mittels elektrischer Heizung oder Außenfeuerung auf die notwendige Temperatur von 600 bis 700° gebracht, worauf die Reaktion eintritt; nach erfolgter Abkühlung tritt das Reaktionsprodukt auf der anderen Seite des Ofens aus. Falls die Temperatur im Innern zu hoch steigt, kann diese durch Luftkühlung reguliert werden. Der notwendige Stickstoff wird dadurch gewonnen, daß man Luft über erhitztes metallisches Kupfer leitet und dadurch von Sauerstoff befreit; das gebildete Kupferoxyd wird dann wieder durch Generatorgas reduziert.
Der nach beiden Verfahren gewonnene Kalkstickstoff enthält etwa 21% N, daneben 17–18% Kohlenstoff, teils gebunden und teils in freier Form beigemischt. Soweit das Produkt nicht unmittelbar der Landwirtschaft zugeführt wird, kann es zu anderen stickstoffhaltigen Produkten verarbeitet werden. Verschmelzen mit Kochsalz liefert Natriumcyanid, Einwirkung von Schwefel oder Kohlensäure bildet Cyanamid CN2H2, das katalytisch in Harnstoff übergeführt werden kann. Das wichtigste Verarbeitungsprodukt ist das Ammoniak, das durch Behandeln mit überhitztem Wasser in hohen eisernen Autoklaven nach folgender Gleichung gebildet wird: CaCN2 + 3H2O = CaCO3 + 2NH3. Das Ammoniak kann dann in Schwefelsäure absorbiert oder auch nach den später zu erwähnenden Verfahren zu Stickoxyden verbrannt werden.
Während des Krieges sind für die Zwecke der Munitionserzeugung und der Landwirtschaft zwei große, nach dem Frank-Caro-Verfahren arbeitende Reichsstickstoffwerke in Piesteritz (Provinz Sachsen) und Chorczow (Oberschlesien) errichtet worden. Das erstgenannte Werk, das mit 60000 KW. arbeitet, hat eine Leistungsfähigkeit von 150000 t Kalkstickstoff, das letztgenannte, das den Spitzenstrom des Oberschlesischen Elektrizitätswerkes in einem Betrag von 40000 KW. ausnutzt, ist im Begriff, durch die Errichtung einer eigenen Zentrale von 20000 KW. für die gleiche Leistung ausgebaut zu werden. Beide Werke stellen auch Salpetersäure für die Munitionserzeugung her. Die gesamte deutsche Produktionsfähigkeit an Kalkstickstoff kann auf etwa[604] 500000 t geschätzt werden. Auch im Ausland sind im Kriege zahlreiche Neuanlagen entstanden, die vielfach auch Salpetersäure aus Ammoniak herstellen; die amerikanischen Anlagen sollen eine Produktionsfähigkeit von 225000 t 100 prozentiger HNO3 haben.
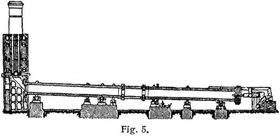
Die Bindung des Luftstickstoffs durch Aluminiumkarbid liegt dem Serpek-Prozeß zugrunde, obwohl dieses selbst bei dem Verfahren nicht isoliert wird, sondern nur als Zwischenprodukt anzunehmen ist. Der endotherme und daher starker Energiezufuhr bedürfende Prozeß vollzieht sich nach folgender Gleichung: Al2O3 + 3C + 2N = 2AlN + 3CO. Als Ausgangsmaterial dient Bauxit, dessen Eisengehalt die Reaktion katalytisch begünstigt. Die Materialien werden zunächst in dem links befindlichen Ofen (Fig. 5) durch verbrennendes Kohlenoxyd vorgewärmt und gelangen dann in den großen Drehofen von 60 bis 80 m Länge und 3 bis 4 m Durchmesser. Die eigentliche Reaktion geht in der Mitte des Drehofens vor sich, wo durch elektrische Widerstandsheizung eine Temperatur von über 1600° erzielt wird; die betreffende Ofenzone ist mit Aluminiumnitrid ausgefüttert, da nur dieses Material selbst der hohen Temperatur gewachsen iß. Das fertige Nitrid wird dann nach folgender Gleichung mit heißem Wasser unter Druck zerlegt: 2AlN + 6H2O = 2NH3 + 2Al(OH)3. Auch kann nach dem Bayer-Verfahren mit Natronlauge reine Tonerde für die Aluminiumfabrikation u.s.w. gewonnen werden.
Die erste Anlage nach dem Serpek-Verfahren ist in Niedermorschweiler bei Mülhausen errichtet worden; eine größere Fabrik ist von der Société Générale des Nitrures in St. Jean de Maurienne in Savoyen erbaut worden. Eine Anzahl weiterer Fabriken ist im Bau oder projektiert, doch scheint infolge der durch die hohe Temperatur bewirkten apparativen Schwierigkeiten das Stadium des Versuchsbetriebes noch nicht überwunden zu sein.
Die Patente der Badischen Anilin- und Sodafabrik, die sich mit der Stickstoffbindung durch Titan und Silicium befassen, sind ebenfalls auf die Société Générale des Nitrures übertragen worden.
3. Direkte Vereinigung von Stickstoff und Wasserstoff nach Haber. Dem Haber-Prozeß liegt folgender chemischer Vorgang zugrunde: N2 + 3H2 ⇄ 2NH3 ± 24 Kalorien. Die Ammoniakbildung ist exotherm, es ist also zu erwarten, daß nur geringer Energieaufwand für die Fabrikation notwendig ist und mithin das Verfahren auch für Länder ohne große Wasserkräfte geeignet ist. Die Ammoniakdarstellung aus den Elementen ist schon von verschiedenen Seiten unter Zuhilfenahme der direkten wie der dunklen elektrischen Entladung, ebenso wie mit Benutzung von Kontaktmaterialien versucht worden, doch erst Haber ist, durch Versuche von Nernst angeregt, auf Grund genauer physiko-chemischer Untersuchungen der Bildungsbedingungen zu praktischen Resultaten gelangt. Wie sich schon aus obiger Gleichung ergibt, muß Ammoniak bei Erhöhung der Temperatur in steigendem Maße zerfallen, indes tiefe Temperatur das Gleichgewicht zugunsten des Ammoniaks verschiebt. Andererseits ist der Stickstoff bei tiefer Temperatur so reaktionsträge, daß die Vereinigung mit dem Wasserstoff sich praktisch zu langsam vollzieht. Es galt also zunächst ein Kontaktmaterial zu finden, das die Reaktionsgeschwindigkeit auch schon bei solchen Temperaturen erheblich steigert, bei denen im Gleichgewicht noch wesentliche Mengen Ammoniak beständig sind. Noch wichtiger war die aus dem Massenwirkungsgesetz abzuleitende Erkenntnis, daß die unter Volumkontraktion verlaufende Ammoniakbildung durch Druckerhöhung begünstigt werden mußte; tatsächlich ergab ein Arbeiten bei erhöhtem Druck erhebliche Steigerung der Ausbeute. Nebenstehende Tabelle gibt die von Haber festgestellten Ammoniakausbeuten wieder. Als Kontaktmaterial erwies sich metallisches Uran als besonders geeignet, das bei 500° und 125 Atm. Druck eine Ausbeute von 11,9 Vol.-Proz. NH3 erreichen läßt. Auch Osmium wirkt günstig, noch besser Ruthenium, die aber beide wegen ihrer Seltenheit überhaupt nicht in Frage kommen. Im praktischen Betrieb wird wohl nur Eisen als Katalysator verwendet, obwohl dieses erst bei höherer Temperatur (bis gegen 700°) günstige Wirksamkeit zeigt. Zahlreiche andere Metalle (Ce, W, Mo, Mn u.s.w.) sind ebenfalls verwendbar, auch wird die Wirksamkeit der Katalysatoren durch sogenannte Aktivatoren, Oxyde, Hydroxyde, Salze der Alkalien, Erdalkalien und Erden und andere Beimengungen in geringem Prozentsatz erheblich erhöht. Wesentlich ist auch, daß die Gase von S-, Se-, P-, As-Verbindungen und anderen Reaktionsgiften sorgfältig vorher befreit werden, da anderenfalls der Katalysator rasch unwirksam wird.
Die außerordentlichen apparativen Schwierigkeiten, die sich durch die gleichzeitige Anwendung eines Drucks von gegen 200 Atm. und einer Temperatur von 500 bis 700° ergaben, sind von der Badischen Anilin- und Sodafabrik, und zwar durch die Konstruktionen von Bosch gelöst worden. Unter den gegebenen Bedingungen wird der Kohlenstoffgehalt des Eisens vom Wasserstoff angegriffen, indes Schmiedeeisen dem Gas den Durchtritt gestattet. Man verfiel daher auf den Ausweg, das heiße Reaktionsrohr aus chemisch widerstandsfähigem, wenn auch durchlässigen Material mit einem zweiten, kühl gehaltenen Rohr so zu umgeben, daß innerhalb und außerhalb des Reaktionsrohrs die Gase unter gleichem Druck zirkulieren, die Reaktionswandung selbst also drucklos ist. Die notwendige Anfangstemperatur soll durch einen Verbrennungsvorgang in der Apparatur erzeugt werden. Im übrigen soll durch die Reaktionswärme und dadurch, daß mit Wärmeregeneration gearbeitet wird, die Temperatur stets auf der notwendigen Höhe[605] gehalten werden. Nur zur Kompression des Gemisches von Wasserstoff und Stickstoff (ersterer wird aus Wassergas, letzterer nach Linde aus Luft dargestellt) ist also ein gewisses Energiequantum aufzuwenden, das aber für das Kilogramm gebundenen Stickstoffs nur 0,5 KW./Stde. beträgt. Das Verfahren ist also nicht in dem Maße wie andere Stickstoffverbindungsverfahren an die Möglichkeit der Beschaffung billiger Energie gebunden und z.B. der Erzeugung von Ammoniak aus Kalkstickstoff ökonomisch überlegen. Das Ammoniak wird durch Abkühlung in verflüssigter Form abgeschieden, indes das unverbundene Gasgemisch ergänzt und in den Kontaktapparat zurückgeführt wird.
Die Badische Anilin- und Sodafabrik hat 1913 ihre große Ammoniakfabrik in Oppau bei Ludwigshafen in Betrieb gesetzt. Neben flüssigem Ammoniak, das in Kesselwagen versendet wird, wurde namentlich im Kriege die Fabrikation von Ammoniumsalzen aller Art (Sulfat, Chlorid, Ammoniaksuperphosphat u.s.w.) aufgenommen; infolge von Schwefelsäuremangel wurde das Sulfat durch Einwirkung von Ammoniak und Kohlensäure auf Gips in allergrößtem Maßstabe dargestellt. (Auch durch Erhitzen von Ammoniumbisulfit bei Gegenwart eines Katalysators kann das Sulfat neben Schwefel gewonnen werden.) Ein großer Teil des Ammoniaks wird zu Stickoxyd verbrannt und so Salpetersäure, Nitrate und nitrathaltige Düngemittel aller Art gewonnen. So wurde neben künstlichem Chilesalpeter nichthygroskopisches Ammoniumnitrat und Calciumnitrat erzeugt, letzteres dadurch, daß das Kristallwasser durch Harnstoff (aus NH3 und CO2) ersetzt wurde; auch Harnstoff an sich wird für Düngezwecke hergestellt. Während des Krieges ist ferner das gewaltige Leunawerk bei Merseburg mit Reichshilfe errichtet worden, so daß die Produktionsfähigkeit der Badischen Anilin- und Sodafabrik etwa 500000 t gebundenen Stickstoff beträgt.
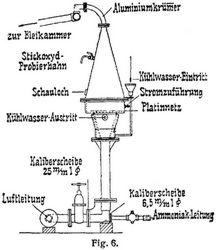
4. Die Verbrennung von Ammoniak zu Stickoxyd bei Gegenwart von Kontaktsubstanzen ist zwar längst bekannt gewesen, in technischem Maßstabe aber erst kurz vor Kriegsbeginn durch Wilhelm Ostwald auf der Zeche Lothringen durchgeführt worden. Während des Krieges ist dort in großem Umfang Kokereiammoniak auf Salpetersäure verarbeitet worden, aber auch die Kalkstickstoffwerke, die Badische Anilin- und Sodafabrik und andere Unternehmungen haben nach eigenen Verfahren Ammoniak verbrannt; während meist Platin als Kontaktmaterial verwendet wurde, hat die Badische Anilin- und Sodafabrik statt dessen Eisenoxyd mit Zusatz von etwas Wismut benutzt. Fig. 6 zeigt ein Verbrennungselement in der von Frank und Caro(Bautag) angegebenen Form. Das sorgfältig gereinigte Ammoniakgas wird mit der notwendigen Luftmenge durch ein Flügelrad aus Aluminium gemischt. Die Gase passieren ein engmaschiges Eisendrahtnetz und gelangen zu dem feinmaschigen, elektrisch geheizten Platinnetz (mit 24–26 Volt Spannung und 120–150 Ampere Stromstärke), wo etwa nach folgender Gleichung die Verbrennung vor sich geht: 4NH3 + 5 (7) O2 = 4NO(NO2) + 6H2O. Die entstandenen Stickoxyde werden gekühlt und entweder (in den Schwefelsäurefabriken) direkt in die Bleikammern eingeführt oder man läßt sie in Tourils oder Granittürmen einem Wasserstrom entgegenströmen, wodurch Salpetersäure erhalten wird, die dann meist in Natronsalpeter übergeführt wird. Die Badische Anilin- und Sodafabrik hat den Prozeß mit einem modifizierten Solvayverfahren verbunden, der neben dem als Düngemittel verwendeten Chlorammonium eine Sodalösung liefert, die zur Absorption der Stickoxyde aus den Endgasen dient; es bildet sich dabei zunächst Nitrit, das dann bei weiterer Behandlung mit nitrosen Gasen in Rieseltürmen bis zur sauren Reaktion in Nitrat übergeht.
Literatur: Donath u. Frenzel, Die techn. Ausnutzung d. atmosph. Stickstoffs, Leipzig 1907. – Bernthsen, Ueber Luftsalpetersäure, Zeitschr. f. angew. Chemie 22, 1167 (1909). – Caro, Industrie d. Kalkstickstoffs u. verwandte Verfahren, Zeitschr. f. angew. Chemie 22, 1178 (1909). – Ruß, Fabrikation d. Luftsalpetersäure in Oesterr. nach d. Vers.d. Salpetersäure-Ind.-Ges., Zeitschr. f. Elektrochemie 15, 544 (1909). – Schönherr, Ueber d. Fabrikation d. Luftsalpeters nach d. Vers.d. Bad. Anilin- u. Sodafabrik, Elektrochem. Zeitschr. 1919, Heft 16/17. – Haber, Gewinnung von Salpetersäure aus Luft, Zeitschr. f. angew. Chemie 23, 684 (1910). – Großmann, Die Stickstoff frage, Berlin 1911. – Bernthsen, Synthet. Gewinnung d. Ammoniaks, Zeitschr. f. angew. Chemie 26, 10 (1913). – Haber, Ueber d. synthet. Gewinnung d. Ammoniaks, Zeitschr. f. angew. Chemie 27, 473 (1914). – Herre, Ammoniak; Kraus, Calciumcyanamid; und Serpek, Aluminiumnitrit; in Ullmann, Enzyklopädie d. techn. Chemie, Berlin-Wien 1914. – Schüphaus, Erzeugung von Stickoxyden aus Ammoniak s.d. Bleikammerprozeß, Metall und Erz XIII (IV) 21 (1916). – Bosch, Mitteilungen über Verarbeitung des Ammoniaks als Düngesalze, Zeitschr. f. Elektrochemie 24, 361 (1918).
Fester.
http://www.zeno.org/Lueger-1904.