- Galvanismus
Galvanismus (Berührungselektrizität), diejenige elektrische Wirkung, die bei der Berührung zweier leitender Körper entsteht.
Durch die Beobachtungen Galvanis [1] angeregt, fand Volta 1793 eine neue Art der Elektrizitätsentwicklung, die bei der Berührung verschiedenartiger Körper, besonders der Metalle, auftrat. Bringt man z.B. eine an einem isolierenden Glasstabe befindliche Zink- und eine ebenso isolierte Kupferscheibe miteinander in Berührung, so zeigt nach dem Auseinandernehmen die Zinkplatte positive, die Kupferplatte negative Elektrizität (Voltas Fundamentalversuch). Es ist also zwischen den Metallen eine Potentialdifferenz aufgetreten, und es muß an der Berührungsstelle eine Kraft vorhanden sein, welche die beiden Elektrizitäten voneinander scheidet und ihre Ausgleichung verhindert. Diese Kraft nennt man elektromotorische Kraft; sie ist von der Natur der sich berührenden Körper abhängig. Die chemische Theorie des Galvanismus[242] hat die neueren Anschauungen über die Vorgänge bei der Elektrolyse zur Grundlage. Hiernach ist die stromerzeugende elektromotorische Kraft der elektrolytische Ueberdruck eines sich lösenden Stoffes (der Elektrode) über den osmotischen Gegendruck der in Lösung befindlichen Ionen (s. Elektrolyse).
Volta prüfte nach der Methode seines Fundamentalversuches eine Reihe von Körpern mittels eines mit Kondensator versehenen Elektrometers und ordnete die Körper nach der Größe des Ausschlages, den sie bei der Berührung hervorbrachten, in eine sogenannte Spannungsreihe, in der jedes Metall bei der Berührung mit einem darauffolgenden positiv, mit einem vorhergehenden dagegen negativ elektrisch wird. Die Voltasche Spannungsreihe lautet: Zink, Blei, Zinn, Eisen, Kupfer, Silber, Gold, Kohle, Graphit, Braunstein. Hierin wird z.B. Zink bei der Berührung mit jedem Körper positiv, Braunstein dagegen negativ. Kupfer wird mit Zink, Blei, Zinn, Eisen negativ, mit den übrigen dagegen positiv. Hierbei hat die elektromotorische Kraft immer eine ganz bestimmte Größe, die nur von der Natur der betreffenden Körper abhängig ist und von der Größe der Berührungsfläche nicht beeinflußt wird. In bezug auf das gegenseitige Verhalten der einzelnen Glieder dieser Spannungsreihe gilt das Gesetz: Die elektromotorische Kraft zwischen zwei leitenden Körpern ist gleich der Summe der elektromotorischen Kräfte zwischen den einzelnen Körpern, die in der Spannungsreihe zwischen jenen beiden stehen. Es ist z.B. die Spannung, die bei der Berührung von Zink und Kupfer entsteht, gleich der Summe der Spannungen Zink – Blei + Blei – Zinn + Zinn – Eisen + Eisen – Kupfer.
Dem Gesetze der Spannungsreihe folgen nur eine Anzahl fester leitender Körper, besonders die Metalle, einige Metallverbindungen, wie z.B. Braunstein, und ferner die Kohle. Volta bezeichnete diese als Leiter erster Klasse. Alle leitenden Flüssigkeiten dagegen, wie z.B. Wasser, Salzlösungen, Säuren u.s.w., erzeugen zwar auch bei der Berührung, besonders mit Metallen, elektromotorische Kräfte, wobei sie selbst in ihre Bestandteile zerlegt werden, fügen sich jedoch diesem Gesetze nicht; diese bezeichnete er als Leiter zweiter Klasse. Bringt man einen Leiter erster Klasse, z.B. eine Metallplatte, in einen zweiter Klasse, also in eine Flüssigkeit, so tritt ebenfalls eine Potentialdifferenz auf, deren Größe von der Beschaffenheit der Flüssigkeit und der des Metalles abhängt, und man hat für die wichtigsten Flüssigkeiten die Metalle derartig in Reihen angeordnet (Spannungsreihen), daß jedes vorangehende in derselben Flüssigkeit eine größere elektromotorische Kraft ergibt als jedes folgende. Als Spannungsreihe der Metalle in verdünnter Schwefelsäure fand Poggendorff: Zink, Eisen, Zinn, Aluminium, Nickel, Wismut, Kupfer, Silber, Platin. In der Reihe steht Zink voran, ergibt also die größte elektromotorische Kraft; bei jedem andern Metall ist sie geringer, und zwar um so mehr, je weiter das Metall vom Zink entfernt ist. Taucht man zwei gleiche Platten in ein und dieselbe Flüssigkeit, z.B. verdünnte Schwefelsäure, so entstehen an beiden Berührungsstellen gleiche elektromotorische Kräfte, aber von entgegengesetzter Richtung, so daß beide Platten wieder gleiches Potential besitzen. Taucht man aber zwei verschiedene Platten, z.B. Zink und Kupfer, in Schwefelsäure, so treten ebenfalls an beiden Berührungsstellen entgegengesetzt gerichtete elektromotorische Kräfte auf, die nun aber nicht mehr gleich sind, sich demnach auch nicht vollständig aufheben. Beide Platten erhalten jetzt verschiedenes Potential, und zwar Zink das niedere und Kupfer das höhere. Diese Potentialdifferenz ist bei denselben Platten und derselben Flüssigkeit stets die gleiche, welches auch die einzelnen Potentiale sein mögen. Beträgt die Potentialdifferenz 1 Volt, so ist das Potential der Kupferplatte stets um 1 Volt höher als das des Zinks. Die elektromotorische Kraft der ganzen Kombination wird um so größer sein, je mehr die beiden elektromotorischen Kräfte an den Berührungsstellen sich voneinander unterscheiden, je weiter also die beiden Metalle in der Spannungsreihe voneinander entfernt sind, oder nach der chemischen Theorie: je größer der Unterschied ihrer Lösungstensionen (s. Elektrolyse) ist. Verbindet man nun die beiden Platten durch einen Leiter, so können die Potentiale sich ausgleichen, es entsteht ein elektrischer Strom. Der Ausgleich ist aber nicht ein einmaliger, sondern da die elektromotorische Kraft die Potentialdifferenz immer wieder erneuert, ein dauernder und ununterbrochener. Es fließt dauernd ein elektrischer Strom von der Platte höheren Potentiales durch den Verbindungsdraht zur Zinkplatte und innerhalb des Elementes vom Zink durch die Flüssigkeit zur andern Platte zurück. Eine solche Vorrichtung nennt man Voltasches oder Galvanisches Element, sie verwandelt die chemische Energie in elektrische. Die äußeren Enden der eintauchenden Platten heißen Pole; zur Befestigung der Stromableitungsdrähte sind an ihnen Klemmschrauben, die Polklemmen, angebracht. Die elektrische Spannung an den Polen des Elementes (Pol- oder Klemmenspannung) ist bei einem stromgebenden Element kleiner als die elektromotorische Kraft, und zwar kleiner um den Spannungsverlust im Innern des Elementes, und dieser ist gleich dem Produkte aus der Stromstärke und dem inneren Widerstande.
Diese einfachste Form des galvanischen Elementes ist für den praktischen Gebrauch nicht geeignet, weil seine an und für sich schon schwache Wirkung infolge der sogenannten Polarisation (s.d.) schnell abnimmt, und es sind deshalb eine Reihe andrer Konstruktionen im Gebrauch, die man als konstante Elemente bezeichnet, da sie wenigstens einige Stunden lang einen annähernd konstanten Strom liefern. Durch die Polarisation wird eine elektromotorische Kraft hervorgerufen, die derjenigen des Elementes entgegenwirkt und von einer Wasserstoffbedeckung der Kathode (Kupferplatte) herrührt. Die Wasserstoffbildung entsteht durch die beim Stromdurchgange eintretende Zersetzung des Elektrolyten, und es wird durch diese schnell zunehmende Bedeckung nicht nur ein Teil der Kathode der direkten Flüssigkeitsberührung entzogen und für die Stromerzeugung unwirksam gemacht, sondern das Wasserstoffgas wirkt auch wie ein Metall und erzeugt eine gegenelektromotorische Kraft.
Nach der chemischen Theorie des Galvanismus (vgl. Elektrolyse) kann man sich den Vorgang folgendermaßen vorstellen. Der Wasserstoff besitzt einen Lösungsdruck, der bezüglich[243] der Stärke dem des Zinks sehr nahe kommt. Als Ueberzug der Kupferplatte wirkt er daher wie eine Zinkplatte und sendet innerhalb des Elektrolyten ebenfalls positive Ionen aus, wodurch naturgemäß die gesamte Ionenbewegung gehemmt und schließlich ganz aufgehoben wird.
Zur Erzielung eines konstanten Elementes muß daher die Polarisation beseitigt werden, was gewöhnlich auf chemischem Wege geschieht, indem man solche Körper (Depolarisatoren) in die Nähe der Kathode bringt, die leicht Sauerstoff abgeben und den frei werdenden Wasserstoff binden. Hierzu eignen sich besonders die Superoxyde, Harke Säuren und verschiedene Salze.
Zu den ältesten und bekannteren der auf diesem Prinzip beruhenden konstanten Elemente gehört das Daniell-Element. Daniell behielt die Elektroden des Volta-Elementes, nämlich Zink und Kupfer, bei, verwendete jedoch zwei Elektrolyte, indem er das Kupfer in eine konzentrierte Lösung von Kupfersulfat und das Zink in verdünnte Schwefelsäure tauchte. Beide Flüssigkeiten waren durch eine poröse Scheidewand (Tonzelle) getrennt, die eine Vermischung hinderte, den Stromdurchgang jedoch ermöglichte. Gibt das Element Strom, so werden durch letzteren beide Elektrolyte zersetzt, wobei an der Anode Zink verbraucht und Zinkvitriol gebildet und an der Kathode Kupfervitriol verbraucht und metallisches Kupfer niedergeschlagen wird.
In dem Verbrauch an Zink besteht der Aufwand an Arbeit, der bei der Erzeugung des Stromes geleistet werden muß. Durch die Verunreinigungen des käuflichen Zinks entstehen an seiner Oberfläche Nebenströme und somit ein nutzloser Zinkverbrauch. Um diese lokalen Wirkungen zu vermeiden, wird die Zinkplatte amalgamiert, d.h. mit einer dünnen Quecksilberschicht versehen. Die zerfetzten bezw. neu entstandenen Mengen verhalten sich theoretisch wie die Atomgewichte, es werden demnach auf 65 Gewichtsteile zerfetzten Zinks 159 Teile Kupfersulfat verbraucht und 63 Teile Kupfer neu gebildet; der wirkliche Verbrauch ist infolge lokaler Nebenwirkungen größer, er beträgt pro Ampèrestunde 27 g Zink und 37 g Kupfersulfat. Die elektromotorische Kraft beträgt ungefähr 1,1 Volt.
Das Daniell-Element wurde früher als sogenanntes Normalelement zur vergleichenden Messung andrer elektromotorischer Kräfte benutzt; jetzt sind hierfür Konstruktionen von konstanterer Wirkung (System Clark, Weston u.a.) im Gebrauch (s. Normalelement).
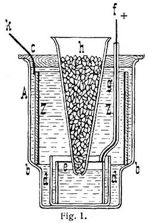
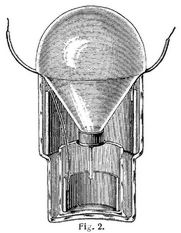
Das Daniell-Element hat verschiedene Vereinfachungen und Abänderungen erfahren und es ist besonders die von Meidinger 1859 angegebene Form (Fig. 1) und eine ähnliche Konstruktion von Kayser & Schmidt, das sogenannte Ballonelement (Fig. 2), vielfach (z.B. in der Telegraphie) im Gebrauch.
Bei dem Meidinger-Element (Fig. 1) ist auf dem Boden eines unten etwas verengten Glasgefäßes A ein kleineres Glas d aufgekittet, in dem sich ein Kupferblech e befindet; an dieses ist ein mit einer Guttaperchahülle oder mit einem aufgeschobenen Glasröhrchen versehener Kupferdraht f gelötet. Das Zink, in Form eines Blechringes Z, ruht auf der Verengerung des Glases A und ist ebenfalls mit einem Draht k versehen. Durch den Holzdeckel ist ein kegelförmiges Glasgefäß h geführt, das in das Glas d hineinragt und unten eine enge Oeffnung besitzt. Das Glas A wird bis zum oberen Rande des Zinkrings mit verdünnter Bittersalzlösung, das Glasrohr h mit Kupfervitriolkristallen und entsprechender Lösung oder Wasser gefüllt. Die sich bildende spezifisch schwerere Kupfervitriollösung sammelt sich an dem Kupferblech in dem Glase d. Die Flüssigkeiten sind also nicht wie beim Daniell-Element durch eine poröse Scheidewand, sondern nur durch ihr verschiedenes spezifisches Gewicht getrennt. Eine Diffusion des Kupfervitriols bis zum Zinkblech findet nur sehr langsam statt; eine solche hat zur Folge, daß sich auf dem Zinkzylinder ein schwarzer Schlamm von niedergeschlagenem Kupfer bildet und sich dieser infolge der dadurch auf ihm entgehenden lokalen Ströme rasch auflöst. Der Widerstand dieser Elemente ist ziemlich bedeutend infolge der ungünstigen Lage der Metallplatten und der geringen Leitungsfähigkeit der Bittersalzlösung. Die elektromotorische Kraft ist nahezu gleich der eines Daniell-Elementes. Sie geben sehr konstante Ströme und halten sich bei richtiger Behandlung mehrere Monate, ohne einer besonderen Wartung außer dem Nachfüllen von Kupfervitriol zu bedürfen. Als Elemente für Telegraphenbatterien haben sie eine bedeutende Verbreitung gefunden. Sie sind wenig transportabel, da eine Mischung ihrer Flüssigkeiten durch Erschütterungen möglichst vermieden werden muß. Eine neuere Form des Meidinger-Elementes zeigt Fig. 2. Bei diesem Elemente ist das Glasgefäß h durch einen Glasballon ersetzt, der unten durch einen paraffinierten und mit einem Ausflußröhrchen versehenen Kork- oder Kautschukstöpsel geschlossen ist.
Andre konstante Elemente mit zwei Flüssigkeiten sind von Grove und von Bunsen angegeben. Bei dem Grove-Element ist die Kupferelektrode durch eine Platinplatte ersetzt, die in starker Salpetersäure steht. Die Zinkplatte befindet sich in verdünnter Schwefelsäure (1 : 10), und beide Flüssigkeiten sind wieder durch eine poröse Scheidewand getrennt. Da Zink und Platin in der Spannungsreihe weit auseinander stehen, so ist die elektromotorische Kraft dieses Elementes sehr groß (ca. 1,9 Volt); auch besitzt es nur einen geringen inneren Widerstand von etwa 0,15 Ohm.
[244] Bei dem Bunsen-Element ist das teure Platin durch die billige Kohle ersetzt; die elektromotorische Kraft beträgt ebenfalls etwa 1,9 Volt.
Bei Verwendung von Kohlenelektroden kann man noch andre Depolarisatoren verwenden, z.B. Chromsäure. Bunsen stellte ein Chromsäureelement her, indem er wieder Zink und Kohle als Elektroden benutzte. Da die Chromsäure das Zink nicht stärker angreift als Schwefelsäure, so braucht man nur eine Flüssigkeit und die Tonzelle fällt fort; der Elektrolyt besteht aus 900 g Wasser, 92 g doppeltchromsaurem Kali und 94 g Schwefelsäure. Die elektromotorische Kraft geht bis zu 2 Volt, der innere Widerstand ist gering. Diese Elemente sind häufig mit einer Vorrichtung zum Herausheben bezw. Eintauchen der Zinkplatte versehen und führen dann den Namen Tauchelemente; wegen ihrer flaschenähnlichen Form heißen sie auch Flaschenelemente.
Zu den Elementen mit nur einer Flüssigkeit gehört auch das sehr verbreitete Leclanché-Element, das besonders in der Haustelegraphie viel benutzt wird. Die Elektroden sind Zink und Kohle; die Beseitigung des Wasserstoffes wird durch Mangansuperoxyd (Braunstein) bewirkt, das die in einer Tonzelle befindliche Kohlenelektrode umgibt; als Elektrolyt dient eine gesättigte Salmiaklösung (Chlorammonium); die elektromotorische Kraft beträgt ca. 1,45 Volt. Bei neueren Ausführungen fehlt die Tonzelle, und die Kathode ist aus einem Gemisch von Braunstein und Kohle gepreßt. Ausführlichere Angaben und Abbildungen der beschriebenen Elemente und Erläuterung der chemischen Vorgänge in denselben in [2], [3].
Das Lalande-Element enthält als negative Elektrode Zink, als positive Eisen oder Kohle, umgeben von Kupferoxyd; der Elektrolyt besteht aus Kalilauge. Das Kupferoxyd ist ein vorzüglicher Depolarisator, da es seinen Sauerstoff leicht an andre Körper abgibt; ebenso leicht nimmt es ihn aus der Luft bei Erwärmung wieder auf, wodurch das Element eine bequeme Regenerierbarkeit erhält. Dasselbe System haben Umbreit & Matthes in Leipzig der Konstruktion ihres viel benutzten Kupron-Elementes zugrunde gelegt. In Kali- oder Natronlauge von 20–22° Bé hängen an einem Hartgummideckel zwei Zinkplatten, zwischen denen sich eine Platte aus festem porösen Kupferoxyd befindet. Behufs Regenerierung der Kupferoxydplatte wird der Deckel nebst Platten abgehoben, gut abgespült und 24 Stunden an einem warmen Ort getrocknet; bei Temperaturen von 100–150° C. läßt sich die Regenerierung schon in 1 Stunde erzielen. Für die Ampèrestunde werden 1,25 g Zink und 6 g Aetzkali verbraucht [4]
Die Beobachtung des Polarisationsstromes (s. oben) führte Grove zur Konstruktion seines Gaselementes, das vorläufig mehr theoretischen Wert hat, besonders als Ausgangspunkt für die Konstruktion der elektrischen Akkumulatoren [4]. Eine neuere Konstruktion eines Gaselementes, auf der Absorption von Kohlenoxydgas (oder von Leuchtgas) beruhend, ist von Borchers angegeben; als Kathode dient eine Kohlenelektrode, als Anode ein Kupferblech, während der Elektrolyt aus Kupferchlorürlösung besteht [2].
Mit dem Namen Trockenelement bezeichnet man ein galvanisches Element, bei dem der Elektrolyt durch Hinzufügen von porösen Körpern, wie Sägespänen, Asbest, Gips, Cellulose, Kieselgur, Baumwolle, oder von klebrigen Substanzen, wie Leim, Hausenblase, Agar-Agar (s. Klebemittel) u. dergl. aufgesaugt bezw. in eine gallertartige oder breiige Masse verwandelt ist. Derartige Elemente werden der bequemen Handhabung und der leichten Transportfähigkeit halber vielfach den nassen Elementen vorgezogen, die in der gewöhnlichen Zusammenstellung gar nicht transportabel sind und außerdem öfters einer Nachfüllung wegen der Verdunstung des Elektrolyten bedürfen. Die Trockenelemente stehen ihnen jedoch insofern nach, als ihr innerer Widerstand meist wesentlich höher ist und bei andauerndem Stromschluß schnell zunimmt; auch sind sie weniger konstant, da die Zirkulation des Elektrolyten aufgehoben und daher die Polarisation nicht vollkommen beseitigt wird. Für viele Zwecke reichen sie jedoch vollständig aus und sind besonders für transportable Meßapparate, bei Isolationsmessungen im Freien und bei Telephonanlagen vielfach in Gebrauch. Die meisten Trockenelemente sind nach dem Leclanché-Typus gebaut und haben eine elektromotorische Kraft von 1,3–1,6 Volt, während der innere Widerstand mitunter 0,5 Ohm und mehr beträgt. Bei dem sehr verbreiteten Trockenelement von Gaßner [2] wird die negative Elektrode durch das zylindrische Zinkgefäß, die positive durch einen hohlen Kohleblock gebildet, während der Zwischenraum zwischen beiden durch eine Mischung von 3 Teilen Gips, 2 Teilen Wasser, 1 Teil Zinkoxyd und 1 Teil Ammoniumchlorid (Salmiak) ausgefüllt ist. Das Zinkoxyd soll eine Auflockerung der Masse bewirken und den inneren Widerstand vermindern. – Hellesens Trockenelement [5], dem ein sehr geringer innerer Widerstand nachgerühmt wird, ist folgendermaßen aufgebaut. Ein innerer Zinkbecher, zylindrisch und vielfach durchlöchert, ist mit einer Pergamentpapier- oder Leinwandschicht ausgekleidet und enthält die positive Elektrode, einen Kohleblock, der von der depolarisierenden Masse umgeben ist. Letztere besteht aus einer Mischung von Braunstein und Graphit, die mit Salmiaklösung angefeuchtet und durch Tragantzusatz klebrig gemacht ist. Dieser Becher wird nun in einen größeren Zinkbehälter, der als negative Elektrode dient, so eingesetzt, daß sowohl am Umfange als auch am Boden ein Zwischenraum bleibt, den eine Paste ausfüllt, die aus Gips und Salmiaklösung unter Zusatz von Tragant hergestellt ist. Da die klebrigen Massen einen sehr guten Kontakt mit den Elektroden herstellen, ist der innere Widerstand gering. Auf ähnlichen Prinzipien beruhende Konstruktionen findet man in [6] angegeben.
Die galvanischen Elemente führen auch den Namen Primärelemente, weil sie direkt Strom liefern, im Gegensatz zu den Sekundärelementen (s. Akkumulatoren), die erst nach vorausgegangener elektrischer Ladung Strom abgeben. Einige galvanische Elemente können, nachdem sie als Primärelemente erschöpft sind, durch Stromdurchleitung regeneriert werden; sie wirken also wie ein Akkumulator, allerdings mit geringem Güteverhältnis. Zu diesen umkehrbaren Elementen (Kehrelementen) gehört z.B. das Daniellsche.
Um die Spannung bezw. die Stromstärke zu erhöhen, kann man die Elemente zu[245] sogenannten Batterien zusammenschalten und sind hierbei folgende Schaltungsarten ausführbar: die Hintereinanderschaltung, die Parallelschaltung und die gemischte Schaltung.
Ist der positive Pol (Kupferplatte) des einen Elementes mit dem negativen (Zinkplatte) des nächsten verbunden, so bezeichnet man die Elemente als hintereinander geschaltet (Schaltung auf Spannung). Hierbei durchfließt ein und derselbe Strom nacheinander alle Elemente, und die elektromotorische Kraft E der ganzen Batterie ist gleich der Summe der elektromotorischen Kräfte der einzelnen Elemente. E = E1 + E2 + E3 + ... En, oder wenn alle n Elemente gleich sind = n E. Für die Stromstärke J ergibt sich dann J = nE/W + nw, worin W der äußere, w der innere Widerstand des Elementes ist.
Um die Stromstärke zu vergrößern, wendet man die Parallelschaltung der Elemente an (Schaltung auf Stromstärke). Hierbei sind alle positiven Pole miteinander und ebenso alle negativen Pole miteinander verbunden und die Stromstärke wird J = E/W + w/n.
Ist der äußere Widerstand sehr groß, so schaltet man die Elemente hintereinander, ist er sehr klein, so schaltet man sie parallel, um eine möglichst große Stromstärke zu erhalten. Ist jedoch der äußere Widerstand im Vergleich zum inneren weder sehr groß noch sehr klein, so findet die gemischte Schaltung Anwendung. Hierbei sind die Elemente zu einzelnen Gruppen parallel und dann diese Gruppen hintereinander, oder sie sind gruppenweise hintereinander und dann erst parallel geschaltet. Hierbei ergibt sich
(m ist die Anzahl der parallel geschalteten Elemente einer Gruppe, n die Gruppenzahl, E die elektromotorische Kraft einer Gruppe). Bei dieser Schaltung wird die größte Stromstärke dann erhalten, wenn sich die Zahl der parallel geschalteten Elemente zur Zahl der hintereinander geschalteten Gruppen verhält wie der innere Widerstand eines Elementes zum äußeren, wenn also m : n = w : W.
Bezüglich der Gesetze des galvanischen Stromes vgl. Elektrodynamik, Elektromagnetismus, Leitungen, elektrische, Strom, elektrischer, Widerstand, elektrischer.
Literatur: [1] Heinke und Ebert, Handbuch der Elektrotechnik, Bd. 1, Leipzig 1904. – [2] Schoop, Die Primärelemente, Halle 1895. – [3] Holzt, Schule des Elektrotechnikers, Bd. 1, Leipzig 1903. – [4] Ebend., Bd. 3. – [5] Zeitschr. für Elektrochemie, Halle 1894–95. – [6] Ebend. 1895–98.
Holzt.
http://www.zeno.org/Lueger-1904.